Western Blot蛋白免疫印跡(WB)快速實驗攻略
完整的WB流程,包含樣本制備、SDS-PAGE、轉膜、抗體結合、蛋白檢測5個大步驟。
Western Blot蛋白免疫印跡(WB)快速實驗攻略
WB即Western Blot,蛋白質免疫印跡。是一種基于抗原抗體的特異性結合,半定量檢測樣品中某種蛋白的技術。作為分子生物學、生物化學和免疫遺傳學中常用的一種經典實驗方法,WB雖看似簡單,卻常因各種因素做不出好看的結果圖,甚至拿不到結果。今天帶領大家從頭開始,一整個過一遍超詳細的實驗流程,保管你一學就會,結果圖好看的讓人敬佩!
完整的WB流程,如下圖所示,包含樣本制備、SDS-PAGE、轉膜、抗體結合、蛋白檢測5個大步驟。
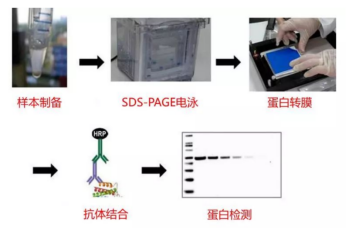
樣品制備
01蛋白提取(以RIPA裂解液為例)
1)融解RIPA裂解液,混勻。取適當量的裂解液,在使用前數分鐘內加入PMSF(Cat# NBS0101),使PMSF的最終濃度為1 mM。
2)貼壁細胞:去除培養液,用PBS(Cat# NBS3021)、生理鹽水或無血清培養液洗一遍。按照6孔板每孔加入150-250 μL裂解液的比例加入裂解液。用槍吹打數下,使裂解液和細胞充分接觸。細胞充分裂解后應沒有明顯的細胞沉淀。
懸浮細胞:離心收集細胞,用手指把細胞用力彈散。按照6孔板每孔細胞加入150-250μL裂解液的比例加入裂解液。再用手指輕彈以充分裂解細胞。充分裂解后應沒有明顯的細胞沉淀。如果細胞量較多,必須分裝成0.5-1×106個細胞/管,然后再裂解。
組織樣本:按照每20mg組織加入150-250μL裂解液的比例加入裂解液。用玻璃勻漿器勻漿,直至充分裂解。
3)充分裂解后,10000-14000 g離心3-5 min,取上清,即可進行后續的PAGE、Western和免疫沉淀等操作。
【注】:RIPA裂解液的裂解產物中經常會出現一小團透明膠狀物,屬正常現象。該透明膠狀物為含有基因組DNA等復合物。在不檢測和基因組DNA結合特別緊密的蛋白的情況下,可以直接離心取上清用于后續實驗;如果需要檢測和基因組結合特別緊密的蛋白,則可以通過超聲處理,或者在裂解液中加入全能核酸酶(Cat#NBS5216)打碎打散該透明膠狀物,隨后離心取上清用于后續實驗。如果檢測一些常見的轉錄因子,例如NF-kappaB、p53等時,通常不必進行超聲處理,就可以檢測到這些轉錄因子。
相關產品詳情
產品貨號 | 產品名稱 | 規格 |
02蛋白定量
1)配制BSA標準品體系
標準品稀釋液為蛋白樣品的溶解液,原則上蛋白樣品在什么溶液中,標準品也宜用什么溶液稀釋。但也可用0.9%的NaCl或1×PBS進行稀釋,配置成梯度濃度的標準品。或者您可以選購BCA蛋白濃度測定試劑盒(Cat# BK0001)直接使用。
2)取25 μL標準品或待測樣品加入到微孔板中。
3)每孔加入200 μL BCA工作液,振蕩30 s充分混勻。蓋上微孔板,37℃孵育30 min。
4)冷卻到室溫,在酶標儀上的540-595 nm波長范圍處檢測吸光度,其中562 nm波長為最佳。
5)根據BSA標準品的吸光度(減去標準品中空白孔的OD值即最終的讀數),繪制標準曲線(X-蛋白濃度ug/mL;Y-最終的OD562 nm)。依據標準曲線和樣品的稀釋倍數計算樣品蛋白濃度。
相關產品詳情:
產品貨號 | 產品名稱 | 規格 |
SDS-PAGE電泳
電泳凝膠可選擇SDS-PAGE凝膠配置試劑盒、PAGE凝膠快速制備試劑盒、預制膠(Bis-Tris體系)三種。
以預制膠操作為例:
1)剪開包裝取出預制膠,撕去膠板底端深綠色膠帶,緩慢地拔出梳子,將預制膠固定在電泳槽中,內槽加滿電泳緩沖液,外槽液體加入量要高于電泳槽高度1/3。可用移液槍或其他工具吸取電泳緩沖液輕輕吹打加樣孔,去除加樣孔內殘留的儲存緩沖液和雜質。
2)在室溫或不超過37℃的水浴中溶解5×SDS-PAGE上樣緩沖液(Cat# NBS1047)。水浴溶解后立即室溫存放。
3)按照每4 μL蛋白樣品加入1 μL 5×SDS-PAGE 蛋白上樣緩沖液的比例,混合蛋白樣品和5×SDS-PAGE蛋白上樣緩沖液。
4)100℃或沸水浴加熱 3-5 min,以充分變性蛋白,之后冷卻至室溫備用。
5)在每個樣品孔中上樣10-30 μg蛋白,并在1個孔中上樣蛋白marker,蓋上電泳槽蓋,打開電源,推薦150 V,跑50-70 min,通常電泳至藍色染料到達膠的底端處附近即可停止電泳。
6)電泳結束,取出凝膠,使用起膠器或其他合適的工具插入到膠板兩側之間的空隙中,慢慢的上下撬動上、中、下三個不同的位置,然后在另一側重復操作,直至膠板兩側完全打開。
7)膠板打開后,凝膠可能粘在膠板的任意一側,將有凝膠一側的膠板傾斜至水中,輕輕撥動凝膠,使凝膠自由掉落到裝有水的器皿中,晃動清洗凝膠,然后取出進行后續轉膜實驗。
相關產品詳情
產品貨號 | 產品名稱 | 規格 |
轉膜與封閉
1)將膠浸于預冷的轉膜緩沖液中平衡5 min。(如果檢測小分子蛋白質,可省略該步驟,因小分子蛋白容易擴散)。
2)依據膠的大小剪取膜和濾紙6片,放入預冷的轉膜緩沖液中平衡10 min,如用PVDF膜,需參照說明書,先用純甲醇浸泡1-2 min,再孵育于預冷的轉膜緩沖液中。(膜的選擇:0.45 μm孔徑,用于一般蛋白;0.22 μm孔徑,用于分子量小于20 kD蛋白)
3)裝配轉移三明治:海綿/3層濾紙/膠/膜/3層濾紙/海綿,每層放好后,用滾輪或試管趕盡氣泡。
4)將轉移槽置于冰浴中,放入三明治,膜靠近陽極,膠靠近陰極,加入Fast Transfer Buffer(20X) 快速轉印緩沖液(20X)(Cat# BR0003-01)中350 mA, 40 min完成轉膜。
5)轉膜結束后,切斷電源,取出膜。
6)將膜浸沒在5 mL麗春紅染色液中,置于軌道搖床上室溫染色5~10 min或更長,直待膜上顯示出蛋白條帶。注:如果沒有出現染色條帶,則表示轉膜失敗,可能需要重新轉膜或重新上樣電泳。
7)清洗:取出膜,用蒸餾水,PBS或者其他適當溶液沖洗至背景清晰后拍照,大概沖洗2~3次,每次5 min。
8)脫色:將膜放到0.1M NaOH溶液漂洗5 min;倒去洗脫液,再重復一次。
9)清洗:再用TBST(Cat# NBS7510)清洗膜2~3次,每次5 min。
10)將膜置于10~20 mL快速無蛋白封閉液(Cat# BR0051-01)中,在室溫振蕩孵育30 min完成封閉。
11)用5 mL TBST(Cat# NBS7510)洗滌三次,每次15 min。
相關產品詳情:
產品貨號 | 產品名稱 | 規格 |
抗體孵育
1)將膜和一抗(按照產品應用推薦稀釋度)置于10 mL一抗稀釋緩沖液中在4oC下孵育過夜并不時輕輕晃動。
2)用5 mL TBST(Cat# NBS7510)洗滌三次,每次15 min以去除殘留的一抗。
3)將膜和二抗(按照產品應用推薦稀釋度)置于10 mL封閉緩沖液中孵育1-2小時并不時輕輕晃動。
4)用5 mL TBST(Cat# NBS7510)洗滌三次,每次15 min。
相關產品詳情:
產品貨號 | 產品名稱 | 規格 |
蛋白檢測
1)最后一次洗膜的同時,按照ECL試劑盒說明書,新鮮配制發光工作液。
2)用平頭鑷取出膜,搭在濾紙上瀝干洗液,勿使膜完全干燥。將膜完全浸入發光工作液(125 μL發光工作液/cm2膜)中,與發光工作液充分接觸。室溫孵育3 min,準備立即壓片曝光。
3)用鑷子夾起膜,搭在濾紙上瀝干發光工作液。但勿洗去發光液。
4)在X光膠片暗盒內表面鋪一張面積大于膜的保鮮膜。將印跡膜貼在保鮮膜上,將保鮮膜折起來完全包裹印跡膜,去除氣泡和皺褶,可剪去邊緣部多余的保鮮膜。用濾紙吸去多余的發光工作液。用膠帶將覆蓋印跡膜的保鮮膜固定在暗盒內,蛋白帶面向上。
5)暗房內壓X光膠片,分別曝光不同的時間,如數秒到數分鐘。顯影沖洗。(從剛開始的10 s曝光時間中可以看出適當的曝光時間。由于檢測反應的動力學特征,在孵育后信號立即變得最強,但在隨后的2小時內會減弱)
相關產品詳情:
產品貨號 | 產品名稱 | 規格 |



